Explicamos o que é uma ligação química e como são classificadas. Exemplos de ligações covalentes, ligações iônicas e ligações metálicas.
O que é uma ligação química?
Uma ligação química é a força que une os átomos para formar compostos químicos . Essa união confere estabilidade ao composto resultante. A energia necessária para quebrar uma ligação química é chamada de energia de ligação.
Nesse processo, os átomos cedem ou compartilham elétrons da camada de valência (camada externa de um átomo onde sua reatividade ou tendência a formar ligações é determinada), e se unem, constituindo novas substâncias homogêneas (não misturas ), inseparáveis por meio mecanismos físicos, como filtragem ou peneiramento .
É um fato que os átomos que compõem a matéria tendem a se unir por meio de vários métodos que equilibram ou compartilham suas cargas elétricas naturais para atingir condições mais estáveis do que quando estão separados. As ligações químicas constituem a formação de moléculas orgânicas e inorgânicas e, portanto, fazem parte da base da existência dos organismos vivos. Da mesma forma, as ligações químicas podem ser quebradas sob certas e certas condições .
Isso pode ocorrer submetendo compostos químicos a altas temperaturas , aplicando eletricidade ou desencadeando reações químicas com outros compostos. Por exemplo, se aplicarmos eletricidade à água, é possível separar as ligações químicas entre o hidrogênio e o oxigênio que a constituem, esse processo é chamado de eletrólise. Outro exemplo é adicionar grandes quantidades de energia calórica a uma proteína , o que levaria a desnaturá-la (perder a estrutura secundária de uma proteína) ou quebrar suas ligações.
Veja também: Modelos atômicos
Tipos de ligação química
Existem três tipos conhecidos de ligação química, dependendo da natureza dos átomos envolvidos:
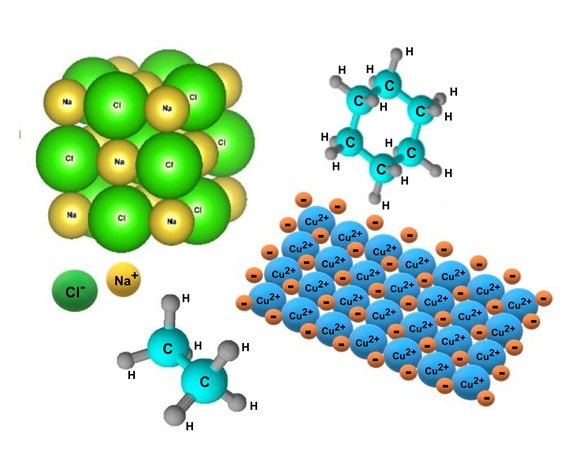
- Ligação covalente . Ocorre entre átomos não metálicos e cargas eletromagnéticas semelhantes (geralmente altas), que unem e compartilham alguns pares de elétrons de sua camada de valência. É o tipo de ligação predominante nas moléculas orgânicas e pode ser de três tipos: simples (AA), dupla (A = A) e tripla (A≡A), dependendo da quantidade de elétrons compartilhados.
- Ligação iônica . Consiste na atração eletrostática entre partículas com cargas elétricas de sinais opostos chamados íons (partícula carregada eletricamente, que pode ser um átomo ou molécula que perdeu ou ganhou elétrons , ou seja, não é neutra).
- Ligação metálica . Ocorre apenas entre átomos metálicos de um mesmo elemento, que geralmente constituem estruturas sólidas extremamente compactas. É uma ligação forte, que une os núcleos atômicos, rodeados por seus elétrons como em uma nuvem.
Exemplos de ligação química
Alguns exemplos de compostos ligados covalentemente :
- Benzeno (C 6 H 6 )
- Metano (CH 4 )
- Glicose (C 6 H 12 O 6 )
- Amônia (NH 3 )
- Freon (CFC)
- Em todas as formas de carbono (C): carbono, diamantes, grafeno, etc.
Alguns exemplos de compostos iônicos ligados :
- Óxido de magnésio (MgO)
- Sulfato de cobre (CuSO 4 )
- Iodeto de potássio (KI)
- Cloreto de manganês (MnCl 2 )
- Carbonato de cálcio (CaCO 3 )
- Sulfeto de ferro (Fe 2 S 3 )
Alguns exemplos de compostos ligados a metais :
- Barras de ferro (Fe)
- Depósitos de cobre (Cu)
- Barras de ouro puro (Au)
- Barras de prata pura (Ag)