Explicamos o que são os modelos atômicos e como eles evoluíram, desde os tempos antigos até os tempos modernos.
O que são modelos atômicos?
Os modelos atômicos são conhecidos como as diferentes representações gráficas da estrutura e operação dos átomos . Modelos atômicos foram desenvolvidos ao longo da história da humanidade a partir das idéias que foram utilizadas em cada época no que diz respeito à composição da matéria .
Os primeiros modelos atômicos datam da Antiguidade clássica , quando filósofos e naturalistas se aventuravam a pensar e deduzir a composição das coisas que existem, ou seja, da matéria.
Veja também: Regra do octeto
Modelo atômico de Demócrito (450 aC)
A “Teoria Atômica do Universo” foi criada pelo filósofo grego Demócrito junto com seu mentor, Leucipo. Naquela época, o conhecimento não era alcançado pela experimentação , mas pelo raciocínio lógico, baseado na formulação e debate de ideias.
Demócrito propôs que o mundo era feito de partículas muito pequenas e indivisíveis , de existência eterna, homogêneas e incompressíveis, cujas únicas diferenças eram na forma e no tamanho, nunca no funcionamento interno. Essas partículas foram batizadas como “átomos”, palavra que vem do grego atémnein e significa “indivisível”.
De acordo com Demócrito, as propriedades da matéria eram determinadas pela maneira como os átomos foram agrupados. Filósofos posteriores como Epicuro adicionaram o movimento aleatório dos átomos à teoria .
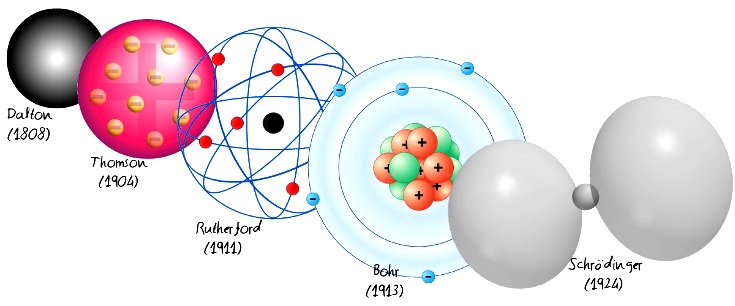
Modelo atômico de Dalton (1803 DC)
O primeiro modelo atômico com bases científicas nasceu dentro da química , proposto por John Dalton em seus “Postulados Atômicos”. Ele afirmava que tudo era feito de átomos, indivisíveis e indestrutíveis , mesmo por meio de reações químicas .
Dalton propôs que os átomos do mesmo elemento químico eram iguais entre si e tinham a mesma massa e as mesmas propriedades. Por outro lado, ele propôs o conceito de peso atômico relativo (o peso de cada elemento em relação ao peso do hidrogênio), comparando as massas de cada elemento com a massa do hidrogênio. Ele também propôs que os átomos podem se combinar para formar compostos químicos.
A teoria de Dalton tinha algumas falhas. Ele afirmou que os compostos químicos foram formados usando o menor número possível de átomos de seus elementos. Por exemplo, a molécula de água , segundo Dalton, seria HO e não H 2 O, que é a fórmula correta. Por outro lado, ele disse que os elementos no estado gasoso sempre foram monoatômicos (compostos de um único átomo), o que sabemos não é real.
Mais em: modelo atômico de Dalton
Modelo atômico de Lewis (1902 DC)
Também chamado de “Modelo do Átomo Cúbico”, neste modelo de Lewis propôs a estrutura dos átomos distribuídos na forma de um cubo , em cujos oito vértices estavam os elétrons . Isso permitiu avançar no estudo das valências atômicas e ligações químicas , principalmente após sua atualização por Irving Langmuir em 1919, onde propôs o “átomo octeto cúbico”.
Esses estudos foram a base do que é conhecido hoje como diagrama de Lewis, uma ferramenta muito útil para explicar a ligação covalente.
Modelo atômico de Thomson (1904 DC)

Proposto por JJ Thomson, descobridor do elétron em 1897, este modelo é anterior à descoberta de prótons e nêutrons , então assumiu que os átomos eram compostos de uma esfera carregada positivamente e elétrons carregados negativamente estavam embutidos nela, como passas no pudim. Esta metáfora deu ao modelo o epíteto de “Modelo de pudim de passas”.
Esse modelo fez uma previsão incorreta da carga positiva no átomo, pois afirmava que ela estava distribuída por todo o átomo. Mais tarde, isso foi corrigido no modelo de Rutherford, onde o núcleo atômico foi definido.
Modelo atômico de Rutherford (1911 DC)
Ernest Rutherford conduziu uma série de experimentos em 1911 usando folha de ouro. Nesses experimentos, ele determinou que o átomo é composto de um núcleo atômico com carga positiva (onde a maior parte de sua massa está concentrada) e elétrons, que giram livremente em torno desse núcleo. Neste modelo, a existência do núcleo atômico é proposta pela primeira vez.
Siga em: modelo atômico de Rutherford
Modelo atômico de Bohr (1913 DC)
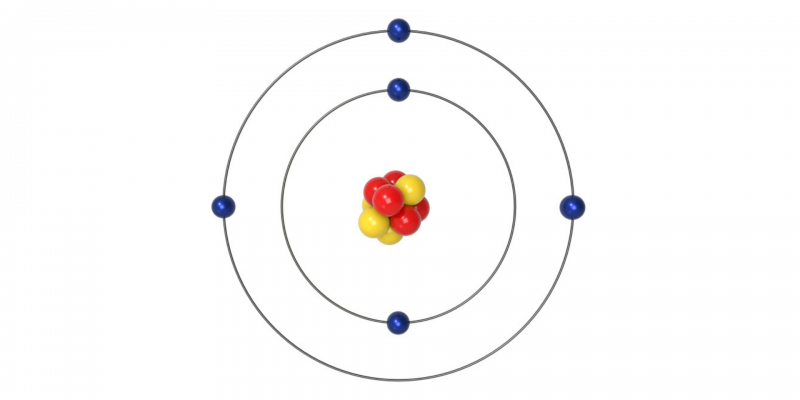
Este modelo começa no mundo da física aos postulados quânticos, razão pela qual é considerado uma transição entre a mecânica clássica e quântica . O físico dinamarquês Niels Bohr propôs este modelo para explicar como os elétrons poderiam ter órbitas estáveis (ou níveis de energia estáveis) ao redor do núcleo. Também explica por que os átomos têm espectros de emissão característicos.
Nos espectros realizados para vários átomos, observou-se que elétrons de um mesmo nível de energia possuíam energias diferentes. Isso mostrou que havia erros no modelo e que deve haver subníveis de energia em cada nível de energia.
O modelo de Bohr é resumido em três postulados:
- Os elétrons traçam órbitas circulares ao redor do núcleo sem irradiar energia .
- As órbitas permitidas aos elétrons são aquelas com um certo valor de momento angular (L) (quantidade de rotação de um objeto) que é um múltiplo inteiro do valor, onde h = 6,6260664 × 10 -34 en = 1, 2, 3 …
- Os elétrons emitem ou absorvem energia ao saltar de uma órbita para outra e, ao fazer isso, emitem um fóton que representa a diferença de energia entre as duas órbitas.
Modelo atômico de Sommerfeld (1916 DC)
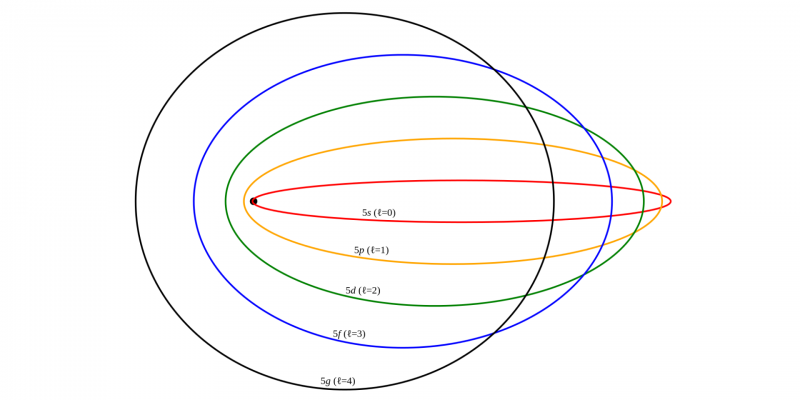
Este modelo foi proposto por Arnold Sommerfield para tentar cobrir as deficiências do modelo de Bohr.
Foi baseado em parte nos postulados relativísticos de Albert Einstein. Entre suas modificações está a afirmação de que as órbitas dos elétrons eram circulares ou elípticas , que os elétrons tinham minúsculas correntes elétricas e que a partir do segundo nível de energia havia dois ou mais subníveis.
Modelo atômico de Schrödinger (1926 DC)
Proposto por Erwin Schrödinger a partir dos estudos de Bohr e Sommerfeld, ele concebeu os elétrons como ondulações da matéria , o que permitiu a formulação subsequente de uma interpretação probabilística da função de onda (uma magnitude que serve para descrever a probabilidade de encontrar uma partícula no espaço) por Max Born.
Isso significa que você pode estudar probabilisticamente a posição de um elétron ou a quantidade de movimento, mas não os dois ao mesmo tempo, por causa do Princípio da Incerteza de Heisenberg.
Este é o modelo atômico em vigor no início do século 21, com alguns acréscimos posteriores. É conhecido como o “Modelo Quantum-Ondulatório”.