Explicamos o que é o ponto de ebulição e como ele é calculado. Exemplos de ponto de ebulição. Ponto de fusão e congelamento.

Qual é o ponto de ebulição?
O ponto de ebulição é a temperatura na qual a pressão de vapor do líquido (pressão exercida pela fase gasosa na fase líquida em um sistema fechado a uma determinada temperatura) é igual à pressão em torno do líquido. Quando isso acontece, o líquido se transforma em gás.
O ponto de ebulição é uma propriedade que depende fortemente da pressão ambiente . Um líquido submetido a uma pressão muito alta terá um ponto de ebulição maior do que se fosse submetido a pressões mais baixas, ou seja, demorará mais para vaporizar quando for submetido a altas pressões. Devido a essas variações do ponto de ebulição, o IUPAC definiu o ponto de ebulição padrão: é a temperatura na qual um líquido se transforma em vapor a uma pressão de 1 bar.
Um ponto importante é que o ponto de ebulição de uma substância não pode ser aumentado indefinidamente . Quando aumentamos a temperatura de um líquido além de seu ponto de ebulição e ainda continuamos a aumentá-lo, alcançamos uma temperatura chamada “temperatura crítica”. A temperatura crítica é aquela acima da qual o gás não pode ser transformado em líquido pelo aumento da pressão, ou seja, não pode ser liquefeito. A esta temperatura, não há fase líquida ou fase de vapor definida.
O ponto de ebulição é diferente para cada substância. Esta propriedade depende da massa molecular da substância e do tipo de forças intermoleculares que apresenta (ligações de hidrogênio, dipolo permanente, dipolo induzido), que por sua vez depende se a substância é polar covalente ou apolar covalente (apolar).
Quando a temperatura de uma substância está abaixo de seu ponto de ebulição, apenas uma parte de suas moléculas localizadas em sua superfície terá energia suficiente para quebrar a tensão superficial do líquido e escapar para a fase de vapor. Por outro lado, quando o calor é fornecido ao sistema, há um aumento na entropia do sistema (tendência à desordem das partículas do sistema).
Veja também: Propriedades da matéria
Como o ponto de ebulição é calculado?
Usando a equação de Clausius-Clapeyron, as transições de fase de um sistema composto por um único componente podem ser caracterizadas. Esta equação pode ser usada para calcular o ponto de ebulição de substâncias e é aplicada da seguinte forma:
Onde:
P 1 é a pressão igual a 1 bar, ou em atmosferas (0,986923 atm)
T 1 é a temperatura de ebulição (ponto de ebulição) do componente, medido a uma pressão de 1 bar (P 1 ) e expressa em graus Kelvin (K).
P 2 é a pressão de vapor do componente expressa em bar ou atm.
T 2 é a temperatura do componente (expressa em graus Kelvin) na qual a pressão de vapor de P 2 é medido .
H é a variação média da entalpia de vaporização na faixa de temperatura que está sendo calculada. É expresso em J / mol ou unidades equivalentes de energia.
R é a constante de gás equivalente a 8,314 J / Kmol
ln é o logaritmo natural
Limpe a temperatura de ebulição (ponto de ebulição) T 1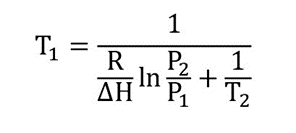
Exemplos de ponto de ebulição
Alguns pontos de ebulição conhecidos e registrados sob condições normais de pressão (1 atm) são os seguintes:
- Água : 100 ºC
- Hélio: -268,9 ºC
- Hidrogênio: -252,8 ºC
- Cálcio: 1484 ºC
- Berílio: 2471 ºC
- Silício: 3265 ºC
- Carbono na forma de grafite: 4827 ºC
- Boro: 3927 ºC
- Molibdênio: 4639 ºC
- Ósmio: 5012 ºC
- Tungstênio: 5930 ºC
Ponto de fusão

A temperatura na qual um sólido se transforma em líquido é chamada de ponto de fusão e é mantida constante durante a transição da fase sólido-líquido. Nesse caso, o calor é fornecido ao sistema até que sua temperatura suba o suficiente para que o movimento de suas partículas na estrutura sólida seja maior, o que faz com que se separem e fluam para a fase líquida.
O ponto de fusão também depende da pressão e geralmente é igual ao ponto de congelamento da matéria (onde um líquido se torna sólido quando resfriado o suficiente) para a maioria das substâncias .
Siga em: Ponto de fusão
Ponto de congelamento
O ponto de congelamento é o oposto do ponto de fusão, ou seja, a temperatura na qual um líquido se contrai , suas partículas perdem o movimento e adquirem uma estrutura mais rígida, resistente à deformação e com memória de forma (única para substâncias no estado sólido ). Ou seja, é a temperatura na qual o líquido se transforma em sólido. A fusão requer o fornecimento de energia térmica ao sistema, enquanto o congelamento requer a remoção da energia térmica (resfriamento).
Por outro lado, o ponto de congelamento também depende da pressão . Um exemplo é o que acontece quando a água é resfriada a uma temperatura de 0ºC a 1 atm, quando congela e vira gelo. Se for resfriado a uma pressão muito diferente de 1 atm, o resultado pode ser muito diferente, por exemplo, se a pressão for muito mais alta, pode demorar para congelar, pois seu ponto de congelamento diminui.
Ponto de fusão e ponto de ebulição da água
A água é freqüentemente usada como padrão ao medir os pontos de fusão e ebulição de substâncias. Em termos gerais, à pressão normal, o seu ponto de ebulição é 100ºC e o seu ponto de fusão é 0ºC (no caso do gelo). Isso pode variar muito nos casos em que a água contém outras substâncias dissolvidas, líquidas ou sólidas, como a água do mar, rica em sais, que modifica suas propriedades físicas e químicas.
O impacto da pressão também é muito perceptível. Sabe-se que a 1 atm o ponto de ebulição da água é de 100 ºC , mas levando-a para 0,06 atm ficaríamos surpresos ao notar que a ebulição ocorre a 0 ºC (ao invés de congelamento).