Explicamos o que é um oxidante, em quais reações ele intervém e alguns exemplos. Combustível e energia de ativação.

O que é um oxidante?
Um oxidante ou oxidante é uma substância ou composto químico que tem a propriedade de se reduzir , ou seja, de ganhar elétrons , quando faz parte de uma reação eletroquímica ou de redução de óxido . São compostos químicos que oxidam outros com os quais reagem, removendo elétrons deles.
Nesse tipo de reação, conhecida como redox , os dois processos ocorrem simultaneamente: a oxidação de um composto (o combustível) e a redução do outro (o oxidante). Todos os compostos envolvidos apresentam um estado de oxidação , e geralmente ocorre liberação de energia durante a reação, ou seja, é uma reação exotérmica . O exemplo clássico desse tipo de reação é a combustão .
O oxidante mais conhecido de todos é o oxigênio , essencial em praticamente todas as formas de combustão e presente na atmosfera terrestre em proporções de até 21%. É por isso que não podemos acender um fogo sem uma presença mínima de ar , pois o ar é uma mistura de oxigênio e outros gases.
Veja também: Fenômenos químicos
Exemplos de oxidante
Alguns agentes oxidantes ou oxidantes conhecidos são os seguintes:
- Oxigênio (O). É o oxidante mais comum no planeta Terra . Na verdade, nós o usamos em nossos corpos para oxidar moléculas de glicose nos alimentos e, assim, obter energia química para nos manter vivos.
- Os alvejantes. Tais como hipoclorito (ClO – ) e outros hipohalitos, bem como cloritos (ClO 2 – ), cloratos (ClO 3 – ) e compostos halógenos semelhantes.
- Peróxido de hidrogênio. Conhecido como peróxido de hidrogênio (H 2 O 2 ).
- Sais de permanganato. Por exemplo, permanganato de potássio (KMnO4).
- Sulfóxidos. Por exemplo, ácido peroxossulfúrico (H 2 SO 5 ).
- Reagente de Tollens. Um complexo aquoso de diamina-prata que é usado em laboratórios, justamente, como oxidante.
- A maioria dos compostos contém Cério (IV).
Oxidante e combustível
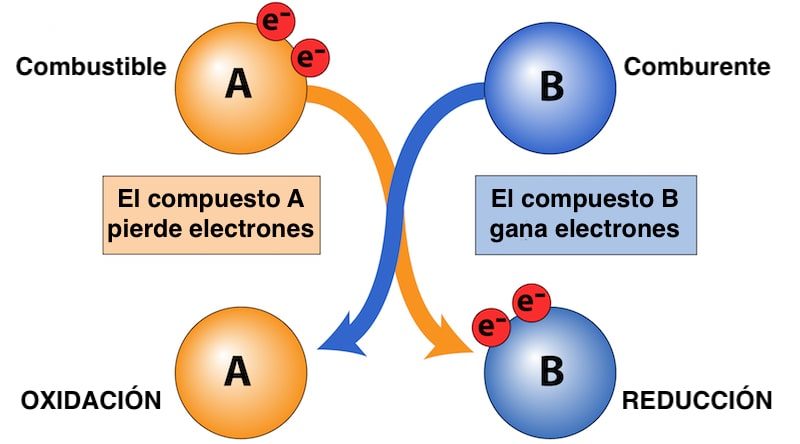
Se o oxidante é o composto que ganha elétrons durante a reação redox, o combustível é a substância que cede os elétrons e oxida , ao contrário do oxidante (que é reduzido).
Ao fazer isso, o combustível libera parte de sua energia química na forma de calor , permitindo que a combustão ocorra, por exemplo. Tanto o combustível quanto o oxidante são essenciais para que esse tipo de reação química ocorra .
Alguns combustíveis típicos são carvão, madeira, hidrocarbonetos , gasolina, gás natural , etc.
Energia de ativação

A energia de ativação é uma carga de energia inicial mínima que desencadeia a reação . É o último elemento necessário para que ocorra a combustão, além do combustível e do oxidante.
Por si só, combustível e oxidante geralmente não reagem , mas se adicionarmos uma carga adicional de energia, na forma de calor , iremos desencadear a combustão até que o combustível seja consumido.
Um exemplo claro é a iluminação de uma fogueira. Temos o combustível (a lenha), o oxidante (o oxigênio do ar), mas precisamos acender um fósforo ou fósforo para poder iniciar a combustão.
O mesmo acontece com o isqueiro: temos o combustível (o gás liquefeito), o oxidante (o oxigênio do ar) e só precisamos da energia adicional da centelha, produzida pelo giro da roda do isqueiro.
Siga com: Risco Químico





