Explicamos o que é uma molécula e exemplos desse conjunto de átomos. Além disso, os tipos que existem e suas diferenças com o átomo.

O que é uma molécula?
Uma molécula é um conjunto de átomos (do mesmo elemento químico ou de muitos elementos diferentes) que se organizam e se inter-relacionam por meio de ligações químicas . Uma molécula também é considerada a menor parte de uma substância que ainda retém as propriedades físicas e químicas da substância. As moléculas são geralmente quimicamente estáveis e eletricamente neutras.
O estado de agregação de uma substância depende em grande parte da estrutura e dos tipos de átomos que compõem suas moléculas, uma vez que estes determinam as forças de interação entre essas partículas . Nesse sentido, sólidos são compostos que possuem pouquíssima separação entre suas moléculas, líquidos possuem separação média ou intermediária entre suas moléculas e gases possuem muita separação entre suas moléculas.
O estudo das moléculas e sua nomenclatura inclui não só o número de átomos que as compõem e as propriedades que apresentam, mas também sua compreensão a partir de um modelo tridimensional de seus vínculos e estruturas, ou seja, da organização no espaço de seus átomos constituintes. Isso significa que existem moléculas que têm a mesma composição atômica, mas estruturas espaciais diferentes (e é por isso que essas moléculas têm nomes diferentes).
As moléculas são muito comuns na química orgânica , pois fazem parte dos gases atmosféricos e dos oceanos . No entanto, existe um grande número de compostos químicos na crosta terrestre que não são moleculares. Por exemplo, a maioria dos metais e minerais da crosta terrestre não são moléculas. Por outro lado, os cristais que constituem os sais também não são moléculas, embora sejam constituídos por unidades repetitivas.
Pode servir para: ligação metálica , ligação covalente , ligação iônica
Exemplos de moléculas

Alguns exemplos de moléculas comuns são:
- Oxigênio : O 2
- Ácido clorídrico : HCl
- Monóxido de carbono : CO
- Ácido sulfúrico : H 2 SO 4
- Etanol : C 2 H 5 OH
- Ácido fosfórico : H 3 PO 4
- Glicose : C 6 H 12 O 6
- Clorofórmio : CHCl 3
- Sacarose : C 12 H 22 O 11
- Ácido para-aminobenzoico : C 7 H 7 NO 2
- Acetona : C 3 H 6 O
- Celulose : (C 6 H 10 O 5 ) n
- Trinitrotolueno : C 7 H 5 N 3 O 6
- Nitrato de prata : AgNO 3
- Ureia : CO (NH 2 ) 2
- Amônia : NH 3
Tipos de moléculas

As moléculas podem ser classificadas de acordo com a complexidade de sua constituição:
- Moléculas discretas. Eles têm um número definido de átomos, sejam dos mesmos elementos ou de diferentes elementos químicos. Elas podem ser classificadas, por sua vez, de acordo com o número de átomos diferentes que compõem sua estrutura: moléculas monoatômicas (o mesmo tipo de átomo), moléculas diatômicas (dois tipos de átomos), moléculas triatômicas (três tipos de átomos), tetraatômicas moléculas (quatro tipos de átomos), etc.
- Macromoléculas ou polímeros . Este é o nome dado às grandes cadeias moleculares. São constituídos por peças mais simples, que se unem para obter sequências extensas e que adquirem propriedades novas e específicas. Os plásticos , por exemplo, são um material composto de macromoléculas orgânicas.
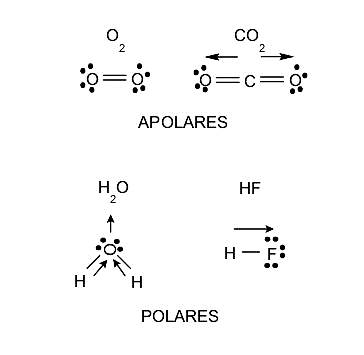
Polaridade é uma propriedade que as moléculas possuem e está intimamente relacionada à separação das cargas elétricas que possui ou que é gerada dentro de cada molécula. Esta propriedade influencia a solubilidade, uma vez que as substâncias polares dissolvem as substâncias polares e as substâncias apolares dissolvem apenas as substâncias apolares, embora sempre existam situações intermediárias. Os pontos de fusão e ebulição , e até mesmo os estados de agregação, também são afetados pela polaridade. Portanto, as moléculas também podem ser classificadas de acordo com sua polaridade em:
- Moléculas polares. São aqueles formados por átomos com eletronegatividade diferente, ou seja, o átomo com maior eletronegatividade atrai os elétrons da ligação para si e com maior força, deixando uma densidade de carga negativa ao seu redor. Em vez disso, uma densidade de carga positiva permanecerá no átomo menos eletronegativo. Esse processo finalmente levará à formação de um dipolo, que é um sistema de duas cargas de sinal oposto e igual magnitude.
- Moléculas não polares. São aqueles cujos átomos possuem eletronegatividade idêntica, ou seja, não apresentam desigualdade no que diz respeito à atração de elétrons e retêm carga neutra em situação normal.
A simetria de uma molécula (a posição que cada um de seus átomos ocupa em sua estrutura) também pode influenciar a determinação se uma molécula é polar ou apolar. Existen moléculas compuestas por átomos de electronegatividad distinta, pero que de igual manera son apolares, pues cuando se suman las densidades de carga de varias partes de la molécula, se anulan estas cargas, y la molécula queda finalmente con carga neutra, es decir, sin carga elétrica.
Diferenças entre átomo e molécula

As moléculas são compostas de átomos ligados entre si por ligações químicas, portanto, os átomos são partículas menores do que as moléculas. Na verdade, a maioria das moléculas pode passar por procedimentos de quebra ou lise de suas ligações químicas, transformando-se em moléculas mais simples, ou em elementos químicos puros, ou seja, átomos.
Molécula de água

Uma molécula de água contém apenas dois elementos: um átomo de oxigênio e dois de hidrogênio (H 2 O) ligados covalentemente. Isso foi descoberto em 1782 graças ao químico Henry Cavendish, já que a água era considerada um elemento desde os tempos antigos.
A água tem uma estrutura não linear. Seus dois átomos de hidrogênio estão ligados ao átomo de oxigênio e formam um ângulo de 104,5º entre si. Essa distribuição de seus átomos, somada ao alto valor de eletronegatividade do átomo de oxigênio, gera a formação de um dipolo elétrico que determina a polaridade da água . Portanto, a água é uma molécula polar.
A água é considerada o solvente universal, uma vez que quase todas as substâncias podem ser dissolvidas nela. As substâncias solúveis em água são polares e chamadas hidrofílicas. As substâncias apolares (apolares), como óleo ou gasolina, são chamadas de hidrofóbicas e não se dissolvem na água.
A molécula de água, extremamente abundante em nosso planeta, também faz parte de muitas substâncias orgânicas e dos corpos de animais e plantas .





