Explicamos o que é uma ligação iônica e suas propriedades. Exemplos e aplicações de compostos formados com esses tipos de ligações.
O que é uma ligação iônica?
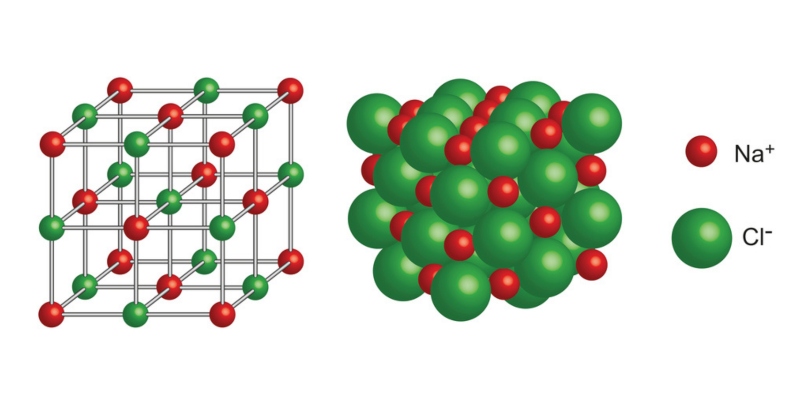
A ligação iônica ou eletrovalente consiste na atração eletrostática entre partículas com cargas elétricas de sinais opostos chamados íons .
Um íon é uma partícula carregada eletricamente. Pode ser um átomo ou molécula que perdeu ou ganhou elétrons , ou seja, não é neutro.
Este tipo de ligação geralmente se manifesta entre átomos metálicos e não metálicos nos quais ocorre a transferência de elétrons dos átomos metálicos (menos eletronegativos) para os não metálicos (mais eletronegativos).
Para que uma ligação iônica se forme, é necessário que a diferença de eletronegatividade (capacidade de um átomo de atrair elétrons de outro átomo quando se combinam em uma ligação química ) entre os dois tipos de átomos seja maior ou igual a 1,7 na escala de Pauling , usado para classificar átomos de acordo com seus valores de eletronegatividade.
Embora a ligação iônica seja normalmente distinta da ligação covalente (consistindo em compartilhar pares eletrônicos da camada externa ou de valência de ambos os átomos), na realidade não há ligação iônica pura, mas este modelo consiste em um exagero da ligação covalente , útil para o estudo do comportamento atômico nesses casos. Sempre há alguma margem de covalência nesses sindicatos.
No entanto, ao contrário dos átomos que formam as ligações covalentes que muitas vezes constituem as moléculas polares, os íons não têm um pólo positivo e outro negativo, mas são inteiramente dominados por uma única carga . Assim, teremos cátions quando um átomo perde elétrons (permanece carregado positivamente) e ânions quando um átomo ganha elétrons (permanece carregado negativamente).
Pode servir para você: Link metálico
Propriedades dos compostos iônicos
Algumas características gerais de um composto iônico:
- Eles são elos fortes. A força dessa ligação atômica pode ser muito forte, de modo que a estrutura desses compostos tende a formar redes de cristal muito resistentes.
- Eles geralmente são sólidos. Em temperaturas e faixas de pressão normais (T = 25ºC e P = 1atm), esses compostos têm uma estrutura molecular rígida e cúbica, que forma redes cristalinas que dão origem aos sais. Existem também líquidos iônicos chamados “sais fundidos”, que são raros, mas extremamente úteis.
- Eles têm um alto ponto de fusão e ebulição. Tanto o ponto de fusão (entre 300ºC e 1000ºC) quanto o ponto de ebulição desses compostos costumam ser muito altos, uma vez que grandes quantidades de energia são necessárias para quebrar a atração eletrostática entre os íons.
- Solubilidade em água. A maioria dos sais é solúvel em água e outras soluções aquosas que possuem um dipolo elétrico (pólos positivo e negativo).
- Condução elétrica. Em seu estado sólido, não são bons condutores de eletricidade, uma vez que os íons ocupam posições muito fixas em uma rede cristalina. Em vez disso, uma vez dissolvidos em água ou solução aquosa, eles se tornam condutores eficazes de eletricidade .
- Seletividade. As ligações iônicas só podem ocorrer entre metais dos grupos IA e IIA da Tabela Periódica e não metais dos grupos VIA e VIIA.
Exemplos de ligação iônica
- Fluoretos (F – ). Ânions que fazem parte dos sais obtidos do ácido fluorídrico (HF). Eles são usados na fabricação de pastas de dente e outros suprimentos dentários.
Exemplos : NaF, KF, LiF, CaF 2
- Sulfatos (SO 4 2- ). Os ânions que fazem parte dos sais ou ésteres obtidos do ácido sulfúrico (H 2 SO 4 ), cuja união a um metal tem diversas aplicações, desde aditivos na obtenção de materiais de construção, até insumos para radiografias contrastadas.
Exemplos : CuSO 4 , CaSO 4 , K 2 SO 4
- Nitratos (NO 3 – ). Ânions que fazem parte dos sais ou ésteres obtidos do ácido nítrico (HNO 3 ), usados na fabricação de pólvora e em inúmeras formulações químicas para fertilizantes ou fertilizantes.
Exemplos : AgNO 3 , KNO 3 , Mg (NO 3 ) 2
- Mercúrio II (Hg 2+ ). Catião obtido do mercúrio, também denominado catião mercúrico e que só é estável em meios com pH ácido (<2). Os compostos de mercúrio são tóxicos para o corpo humano, por isso devem ser manuseados com certas precauções.
Exemplos: HgCl 2 , HgCN 2
- Permanganatos (MnO 4 – ). Os sais do ácido permangânico (HMnO 4 ) possuem uma cor púrpura intensa e um enorme poder oxidante. Essas propriedades podem ser utilizadas na síntese da sacarina, no tratamento de efluentes e na fabricação de desinfetantes.
Exemplos : KMnO 4 , Ca (MnO 4 ) 2





