Explicamos o que é a lei da conservação da matéria ou a Lei de Lomonosov-Lavoisier. História, antecedentes e exemplos.

Lei da conservação da matéria
A lei da conservação da matéria , também conhecida como lei da conservação da massa ou simplesmente como lei de Lomonosov-Lavoisier (em homenagem aos cientistas que a postularam), é um princípio da química que afirma que a matéria não é criada nem é destruído durante uma reação química , ele simplesmente se transforma.
Isso significa que as quantidades das massas envolvidas em uma dada reação devem ser constantes, ou seja, a quantidade de reagentes consumidos é igual à quantidade de produtos formados, mesmo que tenham se transformado uns nos outros.
Este princípio fundamental das ciências naturais foi postulado por dois cientistas simultânea e independentemente: o russo Mikhail Lomonosov em 1748 e o francês Antoine Lavoisier em 1785. É surpreendente que isso tenha ocorrido antes da descoberta do átomo e da postulação da teoria atômica. com o qual é muito mais fácil explicar e ilustrar o fenômeno.
A exceção à regra são as reações nucleares , nas quais é possível converter massa em energia e vice-versa.
Junto com a equivalência entre massa e energia, a lei da conservação da matéria foi a chave para a compreensão da química contemporânea.
Veja também: Reação exotérmica
Antecedentes da Lei da Conservação da Matéria
A química daqueles anos entendeu os processos de reação de uma forma muito diferente da atual, em alguns casos até afirmando o contrário do que esta lei propõe.
No século 17, Robert Boyle experimentou pesar metais antes e depois de permitir que oxidassem . Este cientista atribuiu a mudança no peso desses metais ao ganho de matéria, ignorando que o óxido metálico que se formou veio da reação do metal com o oxigênio do ar .
Descoberta da Lei da Conservação da Matéria
As experiências que levaram Lavoisier à descoberta desse princípio têm a ver com um dos principais interesses da química da época: a combustão . Ao aquecer vários metais, o francês descobriu que eles ganhavam massa quando calcinados se deixados expostos ao ar, mas que sua massa permanecia a mesma se estivessem em recipientes fechados.
Assim, ele deduziu que essa quantidade extra de massa veio de algum lugar. Ele propôs, então, sua teoria de que a massa não foi criada, mas tirada do ar . Portanto, sob condições controladas, a quantidade de massa dos reagentes pode ser medida antes do processo químico e a quantidade de massa depois, que deve ser necessariamente idêntica, embora a natureza dos produtos não o seja mais .
Exemplo da Lei de Conservação da Matéria
Um exemplo perfeito dessa lei é a combustão de hidrocarbonetos , em que o combustível pode ser visto queimando e “desaparecendo”, quando na realidade ele terá se transformado em gases e água invisíveis.
Por exemplo, ao queimar metano (CH 4 ) teremos a seguinte reação, cujos produtos serão água e gases invisíveis, mas com um número de átomos idêntico ao dos reagentes:
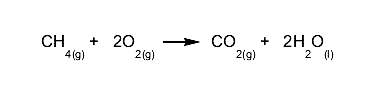
Pode ajudá-lo: Princípio de conservação de energia





