Explicamos o que é combustão, como ocorre e quais são as etapas da reação. Além disso, classificação e exemplos.
O que é combustão?
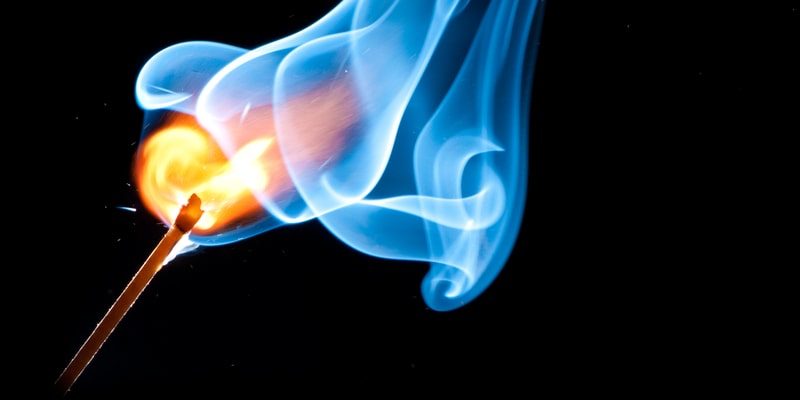
A combustão é um tipo de reação química exotérmica . Pode envolver matéria em estado gasoso ou em estado heterogêneo (líquido-gasoso ou sólido-gasoso). Ele gera luz e calor na maioria dos casos, e é produzido com bastante rapidez.
Tradicionalmente, a combustão é entendida como um processo de rápida oxidação de certos elementos do combustível , ou seja, constituídos principalmente por hidrogênio, carbono e às vezes enxofre. Além disso, ocorre necessariamente na presença de oxigênio.
Na realidade, as combustões são reações redox (redução-oxidação) que podem ocorrer tanto de forma controlada, como em motores de combustão interna, ou de forma descontrolada, como em explosões. Essas reações envolvem a troca de elétrons entre os átomos da matéria durante a reação.
A combustão quase sempre gera energia térmica e luminosa e também produz outras substâncias gasosas e sólidas, como dióxido de carbono (CO 2 ) e vapor d’água , ou ainda os resíduos sólidos do combustível (a substância consumida na reação) e do oxidante (a substância que promove a reação). As substâncias geradas dependem da natureza química dos reagentes envolvidos na combustão.
Desta forma, embora na imagem tradicional da combustão sempre haja fogo envolvido, é possível que o fogo não seja gerado, pois nada mais é do que uma forma de plasma (gás ionizado) produto da liberação de calor da reação química de combustão, que a formar depende das condições e reagentes de cada reação específica.
Veja também: Entalpia
Como ocorre a combustão?
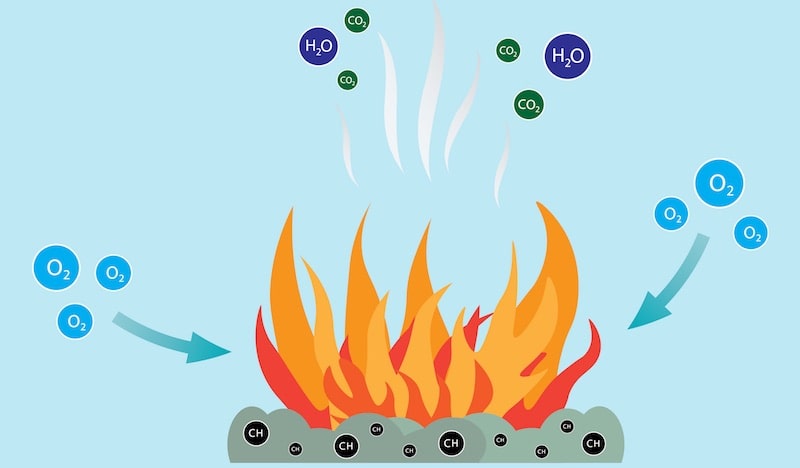
A combustão é um tipo de reação redox , ou seja, uma reação de redução-oxidação. Isso significa que neles um reagente é oxidado (perde elétrons), enquanto o outro é reduzido (ganha elétrons).
No caso da combustão, o oxidante (oxigênio) obtém elétrons do redutor (combustível) , ou seja, o oxidante (oxigênio), obtém elétrons do combustível. Isso geralmente é dado de acordo com a seguinte fórmula:
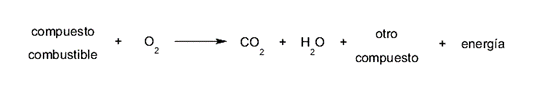
Os compostos do combustível podem variar em cada reação de combustão, dependendo de sua natureza, assim como os níveis de energia gerada podem variar . Mas o dióxido de carbono e a água são produzidos de alguma forma em todas as combustões.
Tipos de combustão
Existem três tipos de combustão:
- Combustões completas ou perfeitas. São aquelas reações em que o material combustível é totalmente oxidado (consumido) e outros compostos oxigenados são produzidos, como dióxido de carbono (CO 2 ) ou dióxido de enxofre (SO 2 ), conforme o caso, e água (H 2 OU )
- Combustões estequiométricas ou neutras. Esse é o nome dado às combustões completas ideais, que usam as quantidades certas de oxigênio para sua reação e que geralmente ocorrem apenas em ambiente controlado de um laboratório.
- Combustões incompletas. São aquelas reações nas quais compostos que não estão completamente oxidados (também chamados de não queimados) aparecem nos gases de combustão. Esses compostos podem ser monóxido de carbono (CO), hidrogênio, partículas de carbono e assim por diante.
Reação de combustão
Os processos de combustão compreendem, na verdade, um conjunto de reações químicas rápidas e simultâneas. Cada uma dessas reações pode ser chamada de estágio ou fase. Os três estágios fundamentais da combustão são:
- Pré-reação ou primeiro estágio. Os hidrocarbonetos presentes no material combustível se decompõem e iniciam sua reação com o oxigênio do ar , formando radicais (compostos molecularmente instáveis). Isso inicia uma reação em cadeia de aparecimento e desaparecimento de compostos químicos onde, em geral, mais compostos são formados do que decompostos.
- Oxidação ou segundo estágio. Nesse estágio, a maior parte da energia térmica da reação é gerada. À medida que o oxigênio reage com os radicais do estágio anterior, um processo de deslocamento violento de elétrons é gerado . No caso de explosões, um grande número de radicais leva a uma reação massiva e violenta.
- Fim da reação ou terceiro estágio. Ocorre quando se completa a oxidação dos radicais e se formam as moléculas estáveis que serão os produtos da combustão.
Exemplos de combustão

Alguns exemplos simples de combustão na vida cotidiana são:
- A iluminação de um fósforo / fósforo. É o caso mais emblemático de combustão. Quando a ponta do fósforo (coberta de fósforo e enxofre) raspa contra uma superfície áspera, ela se aquece com o atrito e dispara uma combustão rápida, que por sua vez produz uma chama curta.
- A iluminação de um fogão a gás. As cozinhas domésticas funcionam através da queima de um gás hidrocarboneto, geralmente uma mistura de propano (C 3 H 8 ) e butano (C 4 H 10 ), que o aparelho extrai de um cano ou recipiente. Colocado em contato com o ar e munido de uma carga inicial de energia térmica (como a chama do piloto ou de um fósforo), o gás inicia sua reação; mas para manter a chama acesa, o combustível deve ser fornecido continuamente.
- Bases fortes e matéria orgânica . A maioria das bases fortes (hidróxidos), como soda cáustica, potassa cáustica e outras substâncias de pH básico extremo, geram reações de oxidação violentas quando entram em contato com matéria orgânica . Isso significa que podemos nos queimar com o contato com essas substâncias e até mesmo iniciar incêndios com elas, já que essas reações costumam ser muito exotérmicas.
- Motores de combustão interna. Esses dispositivos estão presentes em carros, barcos e outros veículos que funcionam com combustíveis fósseis, como diesel, gasolina ou querosene. Eles são um exemplo do uso de combustão controlada. Neles, são consumidos os hidrocarbonetos do combustível e geradas pequenas explosões que, dentro do sistema de pistão, se transformam em movimento , produzindo também gases poluentes, que são lançados na atmosfera .
Siga com: Reações endotérmicas